2025人类遗传资源管理研讨会:激活生物样本价值,赋能全球医药创新

8月8日,"2025年人遗第二次培训暨人源生物样本国际合作与数据应用研讨会"在北京昌平飞镖国际创新中心举行。会议由北京市人类遗传资源管理办公室和昌平区生命谷生物样本转化研究院联合主办,来自政策、临床、技术和产业领域的专家齐聚一堂,共同探讨人类遗传资源的合规管理与创新应用路径。本次活动吸引了60家相关单位的代表,共计130余人踊跃参与。


北京市人类遗传资源管理办公室王锡乐主任为会议致辞。医药健康产业是助推北京创新发展的“双发动机”之一。2018年起,连续滚动实施三轮医药健康协同创新行动计划,医药健康产业创新策源能力和核心竞争力不断增强。2024年北京医药健康产业规模已突破1.06万亿元,成为全国首个万亿级医药健康城市。北京在样本库建设方面处于全国第一梯队,市人遗办将从人遗资源保藏和利用的合规性出发,继续做好人类遗传资源管理服务。

01 伦理筑基:红线意识下的合规智慧
会议在人遗法规深度解读中拉开序幕。首都医科大学附属北京佑安医院伦理专家盛艾娟主任以临床研究及伦理视角切入,深入剖析生物样本库及数据伦理审查的六大核心维度。
风险防控优先:新规强调风险防控先于知情同意,理念发生根本转变。知情同意是核心:特别强调"泛知情同意"需尽可能具体化,告知样本可能使用的领域捐献者随时撤回的权利与途径等。隐私保护刚性要求:严格遵守《个人信息保护法》,采取匿名化、脱敏化等措施保护捐献者。样本来源合法性:杜绝使用来源不明或不合规的样本或数据,入库样本须严格遵循获批知情同意书。样本使用合规性:样本的使用应在捐献者的知情同意范围内使用。 结果告知审慎原则:提供告知选择和途径,对结果可靠、疾病严重、临床可干预且受试者同意的情况进行告知。

北京市人遗办监督一科王国安老师聚焦样本出库利用涉及的人遗实务操作,关键点包括:
·申报类型清晰化:详解采集、保藏、国际合作、材料出境4类行政审批,以及临床试验备案、事先报告、重要家系登记。
·外方单位判定标准:持股超50%、表决权支配、重大影响力等情形均可能被认定。
·国际合作关键点:中方须实质性参与研究并共享数据成果,知识产权原则上需双方共有(注册类临床研究除外)。
·材料出境难点:强调研究方案需包含样本处置全流程,使用样本库标签化样本申请出境时,现行豁免知情路径难实现。
·事先报告必要性:涉及对外提供或开放使用人类遗传资源信息(如基因数据)前,必须进行事先报告与备份。


(面对面交流答疑会)
02 技术破壁:从"冻存"到"智矿"的价值跃迁
活性革命:让细胞在深寒中呼吸
赛维尔科技创始人谭元生博士带来颠覆性突破——玻璃化活性保存技术。大屏上,一段兔肾-150℃保存一年后成功移植的视频引发惊叹:
"传统冻存液甘油/DMSO浓度仅15%,冰晶穿刺如同'万箭穿心';我们将抗凝剂浓度提升至50%以上,让细胞进入无结晶的'玻璃态',脑切片复苏后仍能传导神经电信号。"
其佛山基地已实现角膜、肝小叶等30类组织活体保存,为药企提供接近人体真实反应的实验模型。美国药企正批量采购中国保存的健康肝脏组织,替代误差率高达70%的动物实验。

AI掘金:从沉默数据到靶点富矿
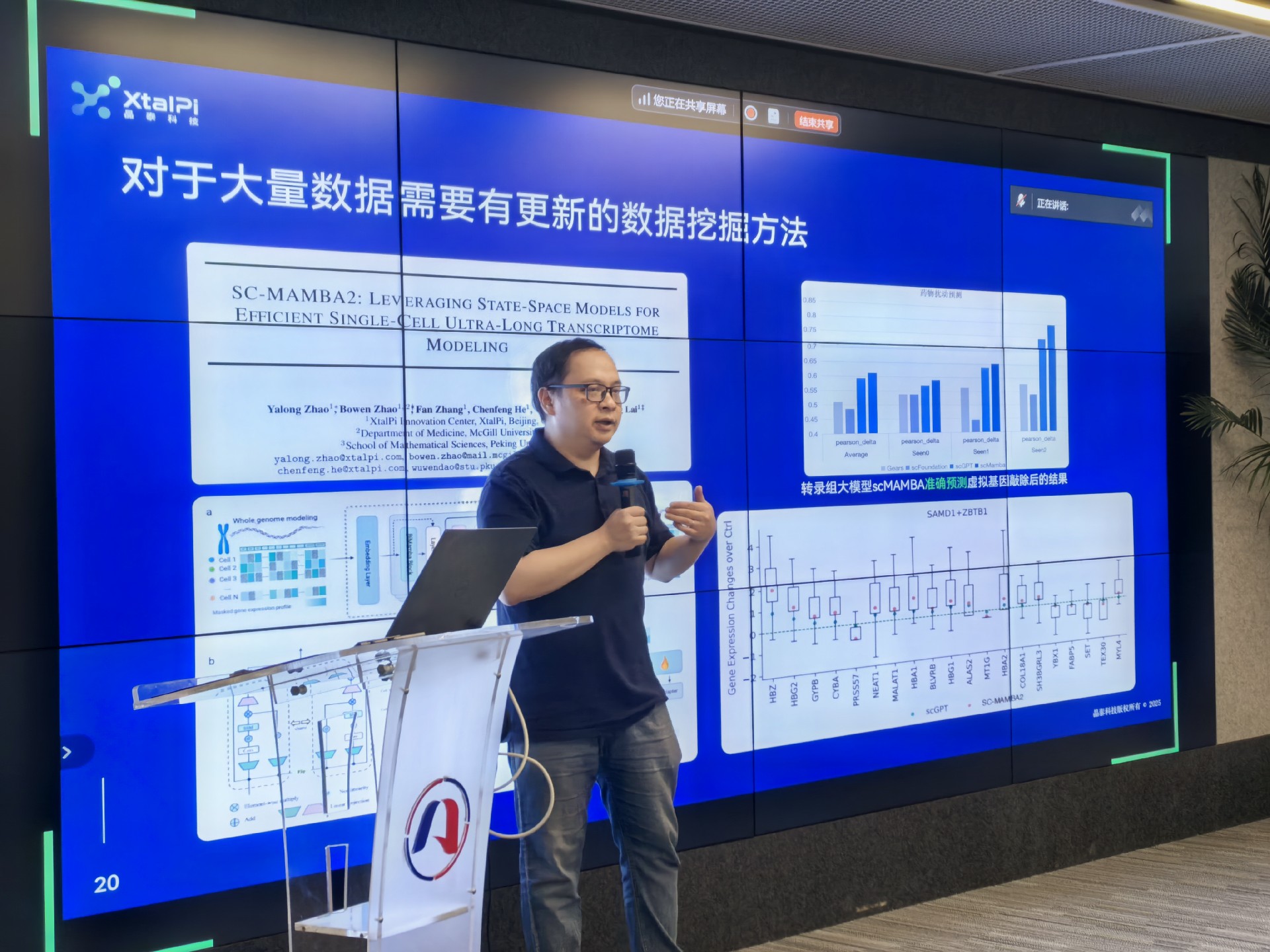
晶泰科技首席创新官赖力鹏博士展示AI如何破解医药研发"三个10"魔咒:
·化学反应预测:30万台自动化合成设备月产30万组数据,训练出的AI模型对"不可能反应"的预判准确率超人类化学家15%;
·靶点挖掘机:千万级文献/专利/临床数据构建的X-Buddy系统,20分钟生成32页靶点研究报告,较人工调研效率提升20倍。
"GPT解决认知问题,但生物医药需要专属'显微镜'——我们正建立虚拟细胞操作系统。基于生物大模型的虚拟细胞模型,实现对于生物系统从可描述→可计算→可设计的演化。"
03 产业觉醒:构建中国样本的全球话语权
质量之痛:从"12%利用率"到工业级品控
生命谷生物样本转化研究院张雷院长犀利点破行业病灶:
"北京74家样本库仅12%出库率,根本在于质量公信力缺失。离心前延迟10分钟,血浆代谢物降解超30%;冻存温度波动5℃,蛋白质变性风险翻倍。当样本离开人体,我们如何证明它还是'它'?"
他援引美国TCGA项目教训:首批2000例样本50%因质量不合格报废,浪费200万美元。呼吁建立"预期用途导向的QA/QC体系",通过标准操作程序(SOP)实现跨机构数据可比性。

04 卫健出手!破样本产业化困局,让"活水"涌起来
北京市卫健委梁亮亮部长指出,北京市卫健委正以 "1+3+X"机制(科委/卫健双牵头+医产学研联动)破冰样本产业化困局。直面"安全"与"生存"双重挑战:生物安全与数据安全如同高悬的"达摩克利斯之剑",必须在合规框架下破除"能做不强、想做不敢"的僵局。
卫健部门三箭齐发注入产业活水:破冰医院数据壁垒,依托研究型病房以课题驱动数据联通;闯出支付新路,探索保险支付加速创新药械临床落地;打通全链条服务,从第三方样本库建设到医疗机构对接提供"嫡系"支撑。"当冰箱里的样本变成食材,技术公司当好厨师,药企愿意为菜品买单——这生态才算真正跑通。"

05 合规破局:在安全与发展间走钢丝
圆桌论坛上,多位专家强调生物样本在医药研发中的不可替代性。武田制药的张永娟指出,临床阶段(I-III期)依赖样本进行生物标志物检测,这对揭示药物机理、筛选有效人群及优化剂量至关重要;伴随诊断开发更需样本识别精准获益人群。
来自阔跃生物的创始人韩晓梅博士介绍,过去,动物实验被视为临床前安全性和有效性的“金标准”。然而,种属差异导致的失败案例逐年攀升:90% 通过动物实验的药物在人体试验折戟。FDA 正在推动的新框架,将首次把“人源样本+类器官/器官芯片”纳入优先推荐路径,并为替代方法提供明确的验证指南。这意味着:
• 动物数据不再是“必须”,而是“可替代”;
• 人源细胞、类器官、微生理系统等将成为申报材料的核心;
• 企业若在早期即布局新方法学,将在 IND 递交时获得更快审评通道。
华辉安健的CSO叶斌博士分享当中国的样本库还停留在“有样本就好”的阶段,美国已把上世纪 80、90 年代的旧库存全部回炉重做,用今天的流行病与统计标准重新补全、重新质控。英国更以一份“从第一次月经追踪到卵巢癌发生”的女性队列成为教科书案例——40 年生命周期数据,让美国流行病学家反复引用。反观国内,大量建库人没有流行病学背景,当美国宾馆癌症中心用标志物筛癌时,他们先让样本库交出一群真正的“健康人”,再与癌症病人做对比,这是我们中国样本库值得去学习的。
专家们提到,FDA新规鼓励以人源样本(如类器官、器官芯片)替代动物实验,因其更贴近真实生理环境,尤其在脑药研究中被视为"金标准"。然而,国内样本获取面临严峻挑战:医院与企业样本体系割裂,临床剩余样本难以合法二次利用,药企被迫高价进口商业样本。数风科技张腾呼吁建立三甲医院与药企的"小联盟",通过标准化合作实现数据共享与合理收费,避免资源浪费。
数据跨境流动的合规解决方案成为焦点。数风科技张腾详解国内路径:依据《个人信息保护法》,药企需明确境外接收方信息、获取个人单独同意,并通过标准合同备案。他强调"合规前置"的必要性,并驳斥国际误解——中国已完成盖茨基金会等案例,证明合理目的的数据出境无障碍。亚马逊云余昶补充技术支撑:外资云服务通过本地合作伙伴运营境内数据中心,满足数据不出境要求;同时建议利用国际公开数据集(如NIH数据库)加速研发。专家一致认为,主动构建合规框架是打通国际合作的关键。
AI驱动药物研发面临临床转化率低的核心矛盾。晶泰科技张亚龙指出,缺乏连接分子设计与临床效果的桥梁是主因,规模化高质量样本库是破局基础。
张雷院长总结呼吁跨领域协作:首先,样本库建设需借鉴英美经验,由流行病学专家主导设计而非学术机构自发;其次,打破医院-药企数据壁垒;最后,政策端需开放商业样本合理流通。与会者强调,单一机构无法解决系统性问题,唯有联合监管方、医院、药企与技术公司构建生态,才能释放生物样本的战略价值,推动中国创新药研发与国际接轨。

06 结语
万亿产业规模之上,北京手握全国领先的生物样本"宝藏"。这场研讨会揭示了解锁宝藏的三重密钥:合规是绝不能逾越的生命线,技术是点石成金的激活器,而医院、企业与政府共建的开放生态,则是让"生命密码"最终转化为治病良方和产业动能的加速场。 当离体器官保存从小时级迈向日级,当AI将海量文献压缩成20分钟的报告,当圆桌专家疾呼"拆墙共建",中国生物医药创新的活水,正从样本库的源头奔涌而来。
正如张雷院长总结:"当医院看到产业化收益,当药企获得均质化样本,当技术平台消解合规焦虑——中国的生物资源将从'战略储备'蜕变为'创新引擎',为全球攻克疑难疾病注入东方动能。"